- Немного из истории
- Состав
- Применение
- Свойства
- Использование нашатырного спирта в быту и медицине
- Запах один, а вещества разные
- Происхождение аммиака
- Происхождение нашатыря
- Происхождение нашатырного спирта
- Сравнение
- Влияние на человека
- История появления аммиака
- Передозировка
- Раствор аммиака. Состав и форма выпуска. Где применяется. Инструкция по применению
- Фармакологическое действие. Фармакодинамика и фармакокинетика
- Показания и противопоказания к применению. Побочные действия
- Передозировка. Воздействие на организм человека паров аммиака. Первая помощь при отравлении
- Взаимодействие
- Условия продажи, условия хранения и срок годности
- Особые указания
- Аналоги
- Для детей
- Роль гидроксида аммония в биологических системах
- Моча с запахом аммиака во время беременности
- Таблица
- Способы получения
- Чем отличается аммиак от нашатырного спирта, нашатыря: отличия
- Нашатырный спирт – формула, происхождение
- Какой раствор аммиака можно применять для огорода
- Правила использования и показания
- Меры предосторожности
- Происхождение нашатыря
- Как развести аммиак, чтобы получить нашатырный спирт: пропорции, процентное соотношение
Немного из истории
Аммиак впервые был получен английским химиком Джозефом Пристли (кстати, одновременно и священником – странное сочетание, не правда ли?) в 1774 году. Он назвал открытый им газ «щелочным воздухом», химического состава которого определить не смог. Это сделал 11 лет спустя, в 1785 году, французский химик Клод Луи Бертолле, известный еще и как изобретатель «бертолетовой соли» – состава, нашедшего широкое применение в пиротехнике и медицине. Почему газ получил именно это название?
На этот счет существует две версии, одна из которых связана с именем древнеегипетского бога Амона, а вторая – со сходным по звучанию оазисом Аммона в Северной Африке. Согласно первой, поклоняющиеся Амону люди во время обряда нюхали нашатырь (химическая формула NH4Cl), при нагревании выделяющий аммиак. По второй версии, в оазисе Аммона, находящемся на перекрестке оживленных караванных путей, в результате постоянного нахождения там большого числа вьючных животных скапливалось огромное количество продуктов их жизнедеятельности. А мочевина, быстро разлагаясь в жарком климате, выделяет аммиак. Какая из двух версий верна – неизвестно.
Отличие аммиака от нашатырного спирта прежде всего в том, что в обычных условиях они находятся в разных агрегатных состояниях. Аммиак – газ, сжижающийся при температуре около –33 по Цельсию. А нашатырный спирт – жидкость, имеющая тот же неприятный запах, что и аммиак. Интересный факт: для транспортировки аммиака из Тольятти в Одессу проложен единственный в своем роде аммиакопровод длиной около 2,1 тысячи километров.
Состав
10% водный раствор аммиака.
Часто людей интересует вопрос, в каких ситуациях применяется нашатырный спирт и что такое аммиак. Химическое соединение нитрид водорода или аммиак представляет собой бесцветный газ с резким запахом. Получают его при высокой температуре с помощью катализатора из азота воздуха и водорода. При добавлении воды получается раствор нашатырного спирта.
Применение
Аммиак – один из важнейших продуктов химической промышленности. Он нашел применение в следующих отраслях:
- в качестве хладагента в холодильном оборудовании (в основном в промышленных установках);
- производство нашатырного спирта;
- производство взрывчатых веществ;
- производство удобрений;
- строительство (в составе противоморозных добавок в растворах);
- производство полимеров, азотной кислоты, соды;
- некоторые другие отрасли.
Применение нашатырного спирта более узко. Львиная доля используется в медицине преимущественно как антисептик или средство для вывода из обморочного состояния. Нашел он применение и в быту. Домохозяйки знают, что нашатырный спирт прекрасно выводит с одежды пятна самого разного происхождения.
Свойства
Раствор обладает слабыми щелочными свойствами. При этом гидроксид аммония может проявлять свойства растворимого и нерастворимого основания.
Свойства, показывающие, что аммиачная вода – щёлочь (растворимое основание):
- меняет окраску индикатора – метилоранж становится жёлтого цвета, лакмус – синего, фенолфталеин – малинового;
- реагирует с кислотами, образуя средние и кислые соли –
2NH3·H2O + H2SO3 → (NH4)2SO3 (средняя соль) + 2H2O или 2NH3·H2O + H2SO3 → NH4HSO3 (кислая соль); - реагирует с кислотными оксидами с образованием нормальной соли –
SO3 + 2NH3·H2O → (NH4)2SO4 + 2H2O; - реагирует с солями –
3NH3·H2O + AlCl3 → Al(OH)3 + 3NH4Cl.

Реакция на индикатор.
Сходство с нерастворимыми основаниями:
- легко разлагается – NH3·H2O → NH3 + H2O;
- реагирует с кислотами;
- не реагирует с амфотерными металлами, их оксидами и гидроксидами.
Амфотерные металлы.
Гидроксид аммония, реагируя с перманганатом калия, проявляет восстановительные свойства:
2NH4OH + 2KMnO4 → 2MnO2↓ + N2↑ + 2KOH + 4H2O.
Нашатырный спирт используется в медицине, в изготовлении удобрений, красителей, соды. В пищевой промышленности используется в качестве добавки E527. В быту аммиачную воду применяют для очистки стёкол, мебели, текстиля.
Использование нашатырного спирта в быту и медицине
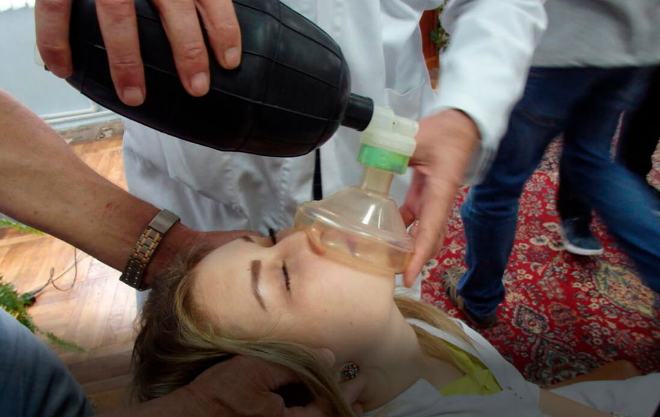
Если спросить человека о применении нашатырного спирта, то он скажет, что с его помощью можно привести человека в сознание. Такое свойство обусловлено невероятно резким запахом. Однако в медицине нашатырный спирт используется не только для приведения человека в чувства.

В медицине нашатырный спирт применяют:
- Для приведения в чувства.
- Чтобы вызвать рвоту при отравлении – в стакан воды капают десять капель раствора и дают выпить.
- Внешне, чтобы унять боль. Водный раствор аммиака охлаждает кожу и помогает справиться с болью.
- При укусах насекомых – чтобы унять зуд. Берут спирт и гидроксид аммония, в пропорции 1:10. Полученным веществом растирают место укуса.
- Хирурги и другие медицинские работники часто применяют его как антисептик для рук, а также для некоторых инструментов, к примеру, игл.
- Во время отравления алкоголем. В стакан воды капают всего пять капель водного раствора аммиака. Применение такого “коктейля” позволяет человеку очнуться, собраться с мыслями и четко отвечать на вопросы.
- В стоматологии при обработке полости рта.
- Раствором удаляют бородавки. Спирт в таком случае не разбавляют, смачивают ватный тампон, прикладывают только к бородавке, избегая здоровую кожу. Ждут максимум шесть секунд, отнимают ватный тампон.
Многие успели оценить применение водного раствора аммиака в быту:
- Для устранения любого запаха. Большинство аэрозолей просто маскирует запах, а нашатырный спирт его полностью устраняет. Однако потом придется проветривать комнату.
- Им выводят пятна. Если на ковре, обивке дивана, на замшевой ткани есть пятно, то нанесите раствор на пятно и ждите, пока вещество “работает”. Не придется тратиться на дорогую химчистку, смывать пену, которая образуется после использования бытовой химии.
- Возвращает первозданную белизну тканям, в том числе и одежде.
- Идеально очищает поверхности. Если загрязнилась поверхность утюга, плитки, духовки, то протрите ее этим раствором. Также позволяет достичь идеального блеска стекла и бокалов.
- Для дезинфекции.
- Как репеллент для насекомых.
- Для чистки ювелирных украшений.
- В качестве удобрения.
Из этой статьи вы узнали, что аммиак, нашатырный спирт и нашатырь — это разные вещества. В быту и медицине применяется нашатырный спирт, а аммиак используют только в промышленности.
Запах один, а вещества разные
Для того чтобы раз и навсегда разубедиться в том, что нашатырный спирт и аммиак — это одно и тоже, достаточно обратиться к истории их происхождения и посмотреть на их химические формулы.
Аммиак — нитрид водорода, газ с молярной массой 17 г/моль, химическая формула — NH3.
Нашатырный или аммиачный спирт — жидкость с химической формулой NH4OH.
Нашатырь — соль с химической формулой — NH4Cl.
Происхождение аммиака
История открытия натурального газа аммиака имеет две легенды. По первой легенде, около храма египетского бога Амона, где совершались религиозные обряды, люди нюхали пары верблюжьих экскрементов, от чего впадали в транс. Эти пары назвали «аммиак».
По второй легенде, в северной Африке в районе оазиса Аммона находилось пересечение караванных путей. Там проходило огромное количество животных, дорога была усеяна их калом и обильно полита мочой, которые испарялись и выделяли газ, который называли «аммиак».
Что касается научного открытия газа с названием «аммиак», то оно датируется 1785 годом. Химическую формулу газа, NH3, определил французский ученый К. Л. Бертолле и назвал его «аммиак».
Но еще в 1774 году английский ученый Д. Пристли получил идентичный газ, которому дал название «щелочной воздух», но химического состава вывести не смог.
Аммиак (ammonia на латыни) — бесцветный газ со специфическим запахом, легче воздуха, химически активный, сжижается при температуре -33 С; хорошо растворяется в воде, имеет щелочную реакцию; взаимодействует с соляной кислотой и образует соль аммония: NH3 + HCl = NH4Cl, которая при нагревании разлагается: NH4Cl = NH3 + HCl.
Получают аммиак двумя способами — промышленным и лабораторным. При лабораторном способе аммиак получается при нагревании щелочей и соли аммония:
- NH4Cl + KOH = NH3 ↑ + KCl + H2O;
- NH4 + + OH — = NH 3 ↑ + H2O.
В промышленных условиях аммиак сначала производится в газообразном виде, а затем его сжижают и доводят до 25%-го водного раствора, который называется аммиачная вода.
Синтез аммиака — это очень важное химическое производство, так как аммиак является основополагающим элементом для многих других химических технологий и производств. Так, аммиак используется в промышленных холодильных установках в качестве хладагента; является отбеливателем при обработке и крашении тканей; незаменим в процессе производства азотной кислоты, азотных удобрений, солей аммония, синтетических волокон — нейлона и капрона.
Промышленный способ синтеза аммиака был изобретен в 1909 году немецким химиком Фрицем Габером. В 1918 году за свое открытие в химии он получил Нобелевскую премию. Первый завод по производству аммиака был запущен в 1913 году в Германии, а в 1928 году производство аммиака было уже налажено в России.
Происхождение нашатыря
Нашатырь (Hammoniaci P. Sal) — это соль, химическая формула NH4Cl (хлорид аммония).
Нашатырь имеет вулканическое происхождение; встречается в горячих источниках, испарениях грунтовых вод, в залежах гуано и самородной серы; образуется при горении угольных пластов или скоплений мусора. Имеет вид натёков, землистых налётов, корочек или массивных скелетных кристаллических скоплений, гроздей и дендритов.
Чистый нашатырь бесцветный или белый, со стеклянным блеском. В зависимости от имеющихся в нем примесей, цвет может быть всех оттенков жёлтого, бурый, серый, разных оттенков красного, коричневый.
При нагревании из нашатыря выделяется аммиак, он хорошо растворяется в воде. Раствор на вкус жгучий едко — солёный, запах резкий аммиачный.
Нашатырь был известен людям с очень давних времен и использовался в ритуальных обрядах, при производстве и окраске тканей, а также алхимиками для пайки металлов и сплавления золота.
В Средние века научились получать искусственный нашатырь из рогов и копыт крупного рогатого скота, который называли «духом оленьего рога».
Происхождение нашатырного спирта
Liquor ammonia caustici — его латинское название.
Это 10-процентный раствор аммиачной воды с химической формулой NH4OH; бесцветная прозрачная однородная смесь, способная испаряться; со специфическим запахом аммиака, который при замерзании сохраняется.
Упоминание о его использовании восточными алхимиками датируется еще VIII веком, а европейскими алхимиками 13 веком. До наших дней дошли их записи об используемых ими рецептурах.
В наши дни получают промышленным и простым бытовым способом:
- промышленным способом синтез проводят из газообразного состояния водорода, азота и воздуха с использованием определенных катализаторов, а затем получают водно-спиртовой раствор, который имеет резкий аммиачный запах;
- простой бытовой способ основан на разведении 25%-ой аммиачной воды до 10%-ого раствора.
Сравнение
Принято считать, что нашатырный спирт – это раствор аммиака в воде, но… Но на деле процесс превращения аммиака в нашатырный спирт имеет не одну ступень, а две. Первая ступень – образование из аммиака гидрата аммония. И вторая – растворение полученного гидрата в воде с образованием того состава, который носит название «нашатырный спирт».
Первая ступень выражается следующей формулой: NH3 + H2O ⇄ NH3 · H20 ⇄ NH4+ + OH— . И только в дальнейшем происходит образование непосредственно нашатырного спирта. Хотя, в сущности, такое разделение – это крючкотворство. Мастера-холодильщики на предприятиях, где используется аммиак, не заморачивая себя химическими формулами, просто опускают шланг, откуда идет аммиак, в ведро с водой, и получают нужное количество нашатырного спирта, который потом применяют для своих нужд (в основном – в быту). Предельная насыщенность раствора при этом определяется на слух: когда начинаются характерные щелчки и треск – все, газ можно перекрывать, нашатырный спирт готов!
Влияние на человека
 При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку и придерживаться правил пользования.
При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку и придерживаться правил пользования.
При намерении использовать аммиак приобретать его надо исключительно в аптеках и внимательно знакомиться с прилагаемыми правилами пользования «Раствор аммиака. Инструкция по применению».
Превышение дозировок может вызвать отравление и серьезные проблемы со здоровьем, а также химические ожоги. Помещения, где он применяется, должны хорошо проветриваться.
Кроме ядовитости, пары аммиака взрывоопасные. Это происходит при смешении их с воздухом в определенной пропорции, поэтому при работе необходимо соблюдать особые правила техники безопасности при работе со взрывчатыми веществами.
Первыми симптомами отравления могут быть:
- появление красных пятен на лице и теле;
- кашель, слезотечение, слюнотечение и чих;
- учащенное дыхание;
- общая возбужденность.
Дальнейшими признаками развития отравления являются:
- появление острой боли за грудиной;
- судороги;
- отек гортани;
- спазм голосовых связок;
- мышечная слабость;
- нарушение кровообращения;
- полуобморочное состояние, вплоть до потери сознания.
При приеме внутрь аммиачной воды в превышающих дозах может возникнуть:
- понос с ложными болезненными позывами;ожог пищевода, желудка и начальных отделов кишечника;
- кашель, слезотечение, слюнотечение и чих;
- остановка дыхания рефлекторного характера;
- рвота с запахом аммиака;
- прием аммиачного спирта в количестве от 10 до 15 гр. грозит летальным исходом.
Если у человека имеется индивидуальная непереносимость к запаху аммиака, то даже незначительное его попадание через дыхательные пути или вовнутрь может сразу привести к самым неблагоприятным последствиям.
Если у человека на теле имеется нарушение кожных покровов в виде мокнущих язв, экзем или дерматитов, то применение примочек может привести к еще более обширной аллергической реакции и ожогам кожных покровов.
История появления аммиака
Впервые аммиак получил в 1774 году английский химик Джозефом Пристли. Открытый им газ получил название “щелочного воздуха”, так как химический состав химик, а одновременно и священник, определить не смог. Лишь спустя 11 лет (в 1785 году) Клод Луи Бертолле — известный французский химик определил химический состав газа и назвал его аммиаком (NH3).
На счет того, почему газ назвали именно так, имеется две версии:
- одну связывают с именем бога древних египтян — Амоном;
- вторую — со сходным по звучанию оазиса в районе северной Африки — “Аммона”.
По первой версии, люди, поклоняющиеся богу Амону, во время обряда нюхали нашатырный спирт.
Важно! Химическая формула нашатыря — NH4Cl. При нагревании он выделяет аммиак, поэтому газ, имеющий химическую формулу NH3, и назвали аммиаком.
Согласно второй — в оазисе Аммона, который находится на перекрестке караванных путей, из-за нахождения огромного количества вьючных животных, скапливались продукты их жизнедеятельности. При условиях жаркого климата мочевина имеет свойство быстро разлагаться и выделять газ, названный аммиаком.
Какая из двух версий достоверная и правильная — неизвестно и по сей день.
Передозировка
Вдыхание паров аммиакав больших количествах вызывает урежение сердечного ритма, а также рефлекторную остановку дыхания.
Если препарат в больших количествах принять внутрь, появляются боль в животе, диарея , рвота с запахом аммиака, возбуждение, судороги. При ингаляционной передозировке — насморк, кашель, остановка дыхания, отек гортани. При наружном применении в больших дозах появляются ожоги.
Цвет слоновой кости в интерьере – как подобрать красивые сочетания фотоЧитайте также:
Раствор аммиака. Состав и форма выпуска. Где применяется. Инструкция по применению
В медицинской сфере используется 10% (100 мг на 1 мл) водный раствор аммиака, формула которого – NH4OHA. Жидкость характеризуется однородной структурой, отсутствием цвета и резким запахом. Вещество обладает высокой летучестью.
Выпускается в различных вариантах фасовки из пластика, прозрачного или темного стекла: ампулах, флаконах, банках или тюбик-капельницах. В упаковках разных производителей может отличаться объем жидкости, всегда прилагается инструкция (применение аммиака требует соблюдения дозировок, т.к. жидкость обладает токсическими свойствами).
Фармакологическое действие. Фармакодинамика и фармакокинетика
По медицинской классификации препарат отнесен к группе стимуляторов дыхания. Лекарственное средство характеризуется следующим фармакологическим действием:
- Обладает антисептическими и дезинфицирующими свойствами.
- При локальном нанесении оказывает раздражающее действие.
- Стимулирует вазомоторный и дыхательный центры.
При местном применении активирует рецепторы, расположенные на поверхности кожи. Стимулирует высвобождение ряда веществ, принимающих участие в развитии аллергических реакций. Оказывает влияние на пептиды в спинном мозге, участвующие в блокировании болевых сигналов.
При попадании в дыхательную систему взаимодействует с рецепторами и активирует дыхательную функцию на рефлекторном уровне. Воздействует на сосудистый тонус. Учащает дыхание и повышает кровяное давление. Высокие концентрации вещества действуют на белки микробной клетки.
Средство оказывает отвлекающий эффект при снятии мышечных и сосудистых спазмов. Воздействует на активность эпителиальной ткани дыхательных путей, способствуя отхождению мокроты. При местном применении стимулирует приток крови и улучшает восстановление тканей.
Вещество характеризуется быстрым выведением из организма при участии бронхиальных желез и легких.

Показания и противопоказания к применению. Побочные действия
Жидкость используется для дезинфекции кожных покровов. Другие области применения аммиака:
- Стимулирование работы легких.
- Интоксикация организма, в т.ч. алкоголем.
- Нейтрализация токсинов после укуса ряда насекомых и змей.
Возможно развитие побочных явлений:
- раздражение слизистой горла;
- остановка дыхания;
- обильное выделение слюны;
- покраснение слизистых оболочек.
Противопоказаниями являются поражения кожи различной этиологии, в т.ч. экзема и дерматит.
Передозировка. Воздействие на организм человека паров аммиака. Первая помощь при отравлении
При передозировке усиливается выраженность побочных явлений. При внутреннем приеме в концентрированном виде вероятен ожог органов пищеварительного тракта. Проникновение в дыхательную систему концентрированных паров провоцирует рефлекторную остановку дыхательного аппарата.
Длительный контакт с парами вызывает мышечную слабость и нарушение циркуляции крови. Признаками отравления могут стать насморк, слезотечение, чихание и кашель, учащение дыхания. Возможно появление боли в грудной области, повышенного потоотделения, удушья, головокружения, рвоты. Может развиться непроизвольное сокращение мышечной ткани гортани и отек голосовых связок.
Длительное воздействие на кожные покровы вызывает ожоги, гиперемию, отечность и болезненность.
Повторные эпизоды отравления вызывают системные нарушения, в т.ч. глухоту, воспаление слизистой оболочки бронхов и пищевые расстройства.
При развитии симптомов сердечной недостаточности существует вероятность летального исхода.
Первая помощь включает следующие меры:
- Необходимо изолировать пострадавшего от воздействия паров.
- Открытые участки кожи обильно промываются водой.
- Глаза обрабатываются Дикаином в соответствующей концентрации.
- Водой промывается горло и носовая полость. Рекомендуется добавление лимонной или глютаминовой кислоты для усиления эффекта.
- При внутреннем отравлении проводится промывание желудка.
Необходимо вызвать скорую медицинскую помощь, т.к. даже при улучшении состояния отравление может спровоцировать осложнения в виде неврологических расстройств, повреждений легочных тканей. При интоксикации от внутреннего приема возможно развитие язвенного кровотечения, рубцового сужения желудка или пищевода.
Взаимодействие
Вещество имеет щелочную среду, поэтому аммиак и кислоты при взаимодействии нейтрализуются.
Условия продажи, условия хранения и срок годности
Препарат отпускается без предъявления рецепта врача. Срок хранения составляет 5 лет. Специальных условий хранения не требуется.
Особые указания
Для ингаляций жидкостью пропитывается небольшой кусок ваты и подносится на расстояние 10 или 15 см от носовых ходов. Для внутреннего приема необходимое количество капель растворяется в воде. Для обработки кожных покровов жидкость смешивается с теплой кипяченой водой.
Аналоги
При отсутствии аммиака в некоторых случаях для ингаляции его заменяют уксусом, ацетоном или спиртом.
Полного аналога у препарата не существует. На фармацевтическом рынке встречаются отхаркивающие средства с добавлением нашатырного спирта и жидкости для рук.
Для детей
Необходимо исключить доступ детей к жидкости. Внутренний прием может привести к летальному исходу. В педиатрии раствор применяется на усмотрение лечащего врача. При стимулировании дыхательной функции нельзя подносить к носу открытый флакон, это может вызвать ожог дыхательный путей.
Роль гидроксида аммония в биологических системах
Данное вещество является важным источником азота для живых систем. Азот – химический элемент, необходимый для биосинтеза аминокислот. Гидроксид аммония применяется в промышленности для получения азотистых удобрений, необходимых для нормального роста и развития сельскохозяйственных культур.
В тканях человека и животных вследствие метаболизма образуется значительное количество аминокислот. Высокие концентрации аммиака в тканях токсичны для организма. Печень преобразовывает гидроксид аммония в менее токсичный для организма продукт – мочевину. Заболевания, результатом которых является дисфункция печени (гепатиты, цирроз печени, холецистит), могут привести к увеличению концентрации вышеуказанного вещества в крови (гипераммониемии). Гидроксид аммиака принимает участие в регуляции кислотно-щелочного баланса в организме.
Моча с запахом аммиака во время беременности
У беременной меняется гормональный фон, и это может вызвать аммиачный запах мочи. Но не следует думать, что только изменение уровня гормонов виновно в том, что урина пахнет нашатырем. Если жидкость внезапно и резко приобрела аромат аммиака, то это может быть последствием таких явлений и состояний:
- Обезвоживание. Встречается при рвоте из-за токсикоза или недостаточного потребления воды во время формирования плацентарного круга кровообращения.
- Застой мочи. На поздних сроках матка может давить на мочеточники и мочевой пузырь, затрудняя выведение жидкости. При застое урины происходит распад мочевины на аммиачные соединения.
- Присоединение инфекций. У беременных естественным образом угнетается иммунитет, чтобы не произошло отторжение плода. Повышается риск пиелонефрита или цистита.
- Прием витаминов и минералов, назначенных врачом.
Периодически появляющийся запах нашатыря от урины при беременности неопасен, если признак сохраняется недолго и самостоятельно исчезает. А вот если жидкость постоянно имеет аммиачный аромат – это повод для обследования.
Таблица
И в завершение подведем итог, в чем разница между аммиаком и нашатырным спиртом.
| Аммиак | Нашатырный спирт | |
| Агрегатное состояние | Газ, сжижается при –33 градусах по Цельсию, что используется в промышленных холодильных установках | Жидкость |
| Химическая формула | NH3 | Фактически – водный раствор аммиака |
| Область применения | Производство широкого спектра продукции – взрывчатые вещества, удобрения, сода, азотная кислота, полимеры и многое другое. Также применяется для производства нашатырного спирта и в качестве хладагента в промышленных холодильных установках | В медицине – как антисептик и средство для выведения из обморочного состояния, в быту – как эффективный пятновыводитель |
Способы получения
В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
N2 + 3H2 ⇄ 2NH3 + Q
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
4. Или нагреванием хлорида аммония с концентрированной щелочью:
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Чем отличается аммиак от нашатырного спирта, нашатыря: отличия
Раствор нашатырного спирта, как мы уже сказали, получается из аммиака. Его хоть и создавали с целью использования в медицине, но в быту он также находит широкое применение. Почему важно это знать?
Прежде всего, аммиак нередко продают в концентрированном виде. Из него делают водный раствор от 25% и выше. В быту категорически запрещено использовать такое средство, потому что над поверхностью раствора всегда содержится скопление газа, который почти в два раза легче воздуха.
Нашатырный спирт
При нагревании гидрат аммония распадается. Это может привести к тому, что при открытии емкости с веществом наружу может вырваться «газовая подушка». Поэтому даже при обмороке человеку нельзя сразу давать нюхать средство из бутылочки. Лучше смочите салфетку. Если не придерживаться этой рекомендации, то вместо усиления дыхания может случиться его остановка.
Более того, концентрированный аммиак очень едкий. Он может повредить не только слизистые оболочки, но и кожу. Через последнюю и даже бытовые резиновые перчатки раствор может просачиваться и травить организм.
Даже если разбавить вещество спиртом самостоятельно, могут возникать негативные последствия. В концентрированных растворах содержится много опасных примесей для здоровья человека.
Последний аргумент — различие формул обоих веществ. Аммиак имеет формулу NH3, а нашатырный спирт — NH4OH.
Нашатырный спирт – формула, происхождение
Аммиак и нашатырный спирт – разные вещества, хотя в состав последнего входит аммиак. Грубо говоря, нашатырный спирт — это водный раствор аммиака, чаще встречается название гидроксид аммония. В состав входит десять процентов аммиака, и девяносто процентов воды. Встречается использование других пропорций, с более высокой концентрацией аммиака.
Формула нашатырного спирта – NH4OH. Это бесцветная смесь, обладает прозрачным цветом, легко испаряется. В процессе испарения выделяет едкий, специфический запах. Что интересно, если водный раствор аммиака замерзнет, резкий запах останется.
Если кто-то говорит, аммиак — это нашатырный спирт, то он не прав. Первый компонент — это газообразное вещество, второй – водный раствор аммиака. А нашатырь обладает твердой формой.
Три компонента отличаются формулой – аммиак (NH3), нашатырь (NH4Cl), нашатырный спирт (NH4OH). Можно выделить две похожие черты – едкий запах и схожесть названий. Этим объясняется то, что люди путают эти вещества.
Всем известно о применении нашатырного спирта в медицине, но многие хозяйки также используют раствор в быту. Первое упоминание об использовании водного раствора аммиака датируется еще 13 веком.
Выделяют два способа производства нашатырного спирта:
- Промышленный – сначала создается аммиачный газ, затем его растворяют в воде, получая водный раствор аммиака.
- Бытовой – покупается двадцатипятипроцентная аммиачная вода. Далее ее разводят водой до получения более слабого, десятипроцентного раствора.



Какой раствор аммиака можно применять для огорода
Итак, аммиак в чистом виде и раствор из него, коим фактически и является нашатырь, используются в разных целях. В то же время приобрести аммиак в аптечных киосках можно только в виде 10-процентного раствора, фактически являющегося нашатырем, поэтому и использовать на приусадебных участках приходится одно и то же средство.
Правила использования и показания
Обычно аммиак идет в ход для отпугивания таких опасных огородных вредителей, как медведка, луковая муха, проволочник, муравьи, личинки майского жука и тля. Высокое содержание азота в химической связке способствует усвоению элемента большинством растений, которые менее охотно берут его из воздуха, невзирая на внушительную долю примеси, достигающую 78%.
Что касается применения, то специалисты приводят следующие рекомендации и пропорции:
- Для профилактики появления медведки и прочих вредителей, атакующих капусту, используется однопроцентный раствор нашатыря, который вносится в грунт перед посадкой (по пол-литра на каждую лунку). Получить такую концентрацию довольно просто, ведь все что для этого нужно – развести 10 мл раствора в ведре воды.

Если же доводится бороться с такими паразитами, как скрытнохоботник и луковая муха, часто поражающими лук и чеснок, то проливать грядки можно на протяжение всего лета, используя пропорцию в 25 мл нашатыря на 10 л воды. В случае выявления повреждений производится опрыскивание смесью, состоящей из 50 мл спирта и 10 мл жидкого мыла, разведенного в таком же количестве воды. - Для применения в качестве подкормки, которая рекомендуется в случае выявления дефицита азотистых веществ в почве (скрученная листва, скудное цветение или его отсутствие), используется концентрат, приготовленный из 6 ст. л. аммиачного раствора, разведенного в 10 л воды. Внесение подкормки производится под корень не чаще чем раз в неделю. На заметку!Если же на повестке дня стоит вопрос о профилактике азотного дефицита, что актуально для скудных почв, то подкормка (50 мл раствора на ведро воды) производится раз в две недели.
- Для обработки лука и других корнеплодов, на которые нашатырь оказывает максимально эффективное воздействие, рекомендуется проливать грядки 2-3 раза в неделю, растворив в ведре 60 мл спирта. Неплохо зарекомендовала себя и внекорневая подкормка, выполняемая уже после захода солнца.
- Подкормка огурцов производится до плодоношения, для чего раз в неделю используется слабый раствор, приготовленный из 3 ст. л. нашатыря и 10 л воды. Как только начнет образовываться завязь, рекомендуется увеличить концентрацию до 1 ч. л. на каждые 1,5 л воды и частоту внесения.
- Удобряют таким образом и чеснок, особенно если кончики его ботвы начинают сохнуть и истончаться, для чего необходимо развести 2 ст. л. спирта в 10 л воды. Такая же концентрация используется и для помидоров, своевременная и регулярная подкормка которых помогает делать кусты крепкими, а плоды крупными и мясистыми.
Важно помнить, что внесение аммиачного раствора является целесообразным только в том случае, если почва страдает от недостатка азота, что приводит к слабому цветению и низкой урожайности. Объясняется это тем, что избыток вещества также опасен, как и его дефицит.
Плюсы и минусы аммиакаНа самом деле плюсов в нем немного, а точнее один – резкий запах, отпугивающий насекомых. А если учесть, что таким же ароматом обладает и нашатырный спирт, то в применении чистого аммиака отпадает всякая необходимость.Что касается недостатков, то прежде всего речь идет об агрессивном воздействии на почву, растения и человека (вещество официально относится к ядовитым концентратам).Плюсы и минусы раствора аммиакаполная безопасность для растений и человека;высокая эффективность в борьбе с огородными вредителями;высокое содержание азота в составе;легкая растворяемость и быстрое приготовление раствора в любой концентрации;доступная цена.Не обошлось и без недостатков, которые по большому счету определяются составом почвы. Так, внесение нашатыря в грунт с высоким содержанием азота может дать обратный эффект.
Меры предосторожности
Необходимо соблюдать повышенную осторожность при использовании средства и не игнорировать индивидуальные средства защиты. Безопасность применения нашатыря будет во многом зависеть от следования простейшим правилам:

- разводить гидроксид аммиака следует на воздухе или в хорошо проветриваемом помещении;
- нужно избегать попадания нашатыря на кожу лица;
- хранят препарат в закрытом и недоступном для детей месте;
- вдыхать пары аммиака запрещено людям, которые страдают вегетососудистой дистонией;
- запрещается смешивать спирт с другими веществами.
При использовании нашатыря в качестве удобрения и подкормки для растений следует применять резиновые перчатки и специальную защитную маску. Если по какой-либо причине нерастворенный гидроксид аммиака попал внутрь, необходимо выпить большое количество воды, вызвать рвоту, после чего обратиться к врачу за помощью.
Происхождение нашатыря
Как уже было указано, формула аммиака – NH3, а химическая формула нашатыря – NH4Cl. Это первое отличие нашатыря (второе название – хлорид аммония) от аммиака, или даже нашатырного спирта. Второе заключается в форме хлорида аммония – в природе он встречается в виде скоплений кристаллов, землистых налетов, дендритов и массивных гроздей.
В чистом виде, без примесей солей или других веществ, хлорид аммония обладает белым цветом, также встречается прозрачный нашатырь. Обладает характерным стеклянным блеском. Если в состав хлорида вошли примеси, то цвет меняется. В природе встречается нашатырь желтого, бурого, коричневого, серого цвета, а также почти всех оттенков красного.

Обладает вулканическим происхождением, часто его можно найти возле горячих источников, в местах испарения грунтовых вод, в области скопления гуано, возле залежей самородной серы.
Обратите внимание! Если кристаллы нашатыря нагреть, то начнет выделятся аммиак. Он отлично растворяется в воде и из него образуют водный раствор аммиака. В газообразном виде обладает резким запахом, если растворить в воде, то на вкус водный раствор аммиака соленый, обладает жгучими свойствами.
Человечество давно начало пользоваться хлоридом аммония. В древние времена кристаллам приписывали магические свойства, поэтому использовали при проведении обрядов. Более практичное применение нашли позже – с помощью нашатыря красили ткань, а алхимики использовали для лучшей спайки разных металлов. Также кристаллы применяли для плавления золота.
В Средневековье люди научились выводить хлорид аммония искусственным путем. В процессе использовались копыта и рога крупного скота. Нашатырь получил в те времена весьма интересное название – “дух оленьего рога”.
Как развести аммиак, чтобы получить нашатырный спирт: пропорции, процентное соотношение
Как мы уже сказали, не рекомендуется готовить раствор нашатырного спирта. Все же есть способ это сделать. Обычно такое средство используется в быту, чтобы избавиться от насекомых или устранить неприятные запахи на кухне. Для этого надо 1 часть нашатырного спирта смешать 9 частями воды. В процентном соотношении это выглядит следующим образом — 10% спирта и 90% процентов воды.
Более сложный способ чем-то напоминает приготовление медицинского спирта. Различие только в количестве компонентов.

Как сделать нашатырь самостоятельно?
Готовится вещество из водки. Но только недостаточно просто ее купить и заморозить. Это не даст нужного результата, а потому вам потребуется самогонный аппарат. Конечно, после его использования у вас получится что-то крепче водки, но все же не чистый спирт. Для его получения требуется перегонка водки.
Вам потребуется для этого:
- Кондитерские дрожжи
- Простой пакет
- Стеклянная банка
У вас все должно находиться под рукой. Итак, приготовление будет следующим:
- Вылейте сок или морс, который вы приготовили в стеклянную банку
- Добавьте к нему дрожжи. Рассчитывайте, что на 1,5 литра напитка добавляется 30 г дрожжей
- Хорошо смешайте состав и закройте крышкой
- Закрытую банку поместите на батарею
- Открывайте ее каждый день, чтобы выходил углекислый газ. Если этого не делать, то потом и не удивляйтесь, что ваша банка взорвалась
- Так делайте несколько дней, пока не выделится спирт. Чем дольше вы будете хранить банку, тем больше выделится спирта
- Через какое-то время смесь застынет и спирт можно будет слить
Чтобы убедиться, что у вас точно получился нашатырь, налейте немного жидкости в столовую ложку и снизу попробуйте нагреть. Она должна вспыхнуть.
